Percobaan
I
Pemisahan
dan Pemurnian Zat Cair
Distilasi
dan Titik Didih
A. Tujuan Percobaan
1.
Mengetahui dan memahami prinsip distilasi
2.
Mampu merangkai dan menggunakan peralatan distilasi
terfraksi dan distilasi vakum
3.
Mampu melakukan distilasi untuk pemisahan dan pemurnian
4.
Menguasai pengertian campuran azeotrop
B. Prinsip Percobaan
Distilasi
adalah suatu proses untuk memisahkan dan memurnikan suatu campuran tertentu
dari komponen-komponennya karena adanya perbedaan titik didih. Distilasi dilakukan
dengan memanaskan suatu campuran sampai salah satu komponen yang lebih mudah
menguap menjadi fase uap, dan kemudian mendinginkan uap tersebut untuk
mendapatkan komponen tersebut dalam bentuk cair dengan kondensasi.
Titik
didih sendiri bermakna sebagai temperatur saat tekanan gas sama dengan tekanan
atmosfer.
Dalam
proses penguapan, biasanya tujuannya adalah untuk mendapatkan bahan yang lebih
sulit menguap; bahan yang lebih mudah menguap, biasanya air, dibuang. Berbeda
dengan distilasi, tujuan utamanya adalah untuk memurnikan bahan yang lebih
mudah menguap. Contohnya adalah pemurnian dengan menyingkirkan air dari
gliserin disebut sebagai penguapan, sedangkan pemurnian dengan menyingkirkan
air dari alkohol dengan menguapkan alkohol terlebih dahulu disebut distilasi,
walaupun alat untuk melakukan kedua proses tersebut sama.
Prinsip
kerja distilasi sebenarnya adalah dengan memanfaatkan sifat ke-mudah-menguapan
dari suatu komponen. Dalam sebuah campuran sederhana dua cairan yang saling
menguap, kecenderungan mereka untuk menguap tidak terpengaruh dengan kehadiran
satu sama lain. Dalam kasus seperti itu, titik didih dari campuran 1:1,
misalnya, akan bernilai rata-rata dari titik didih kedua komponen tersebut.
Pemisahan dari kedua substansi yang dihasilkan dari satu distilasi akan bergantung
hanya pada tekanan uap, atau kecenderungan untuk menguap, dari komponen yang
berbeda-beda pada temperatur ini. Hubungan ini pertama kali dikemukakan oleh
kimiawan Perancis François Marie Raoult (1830-1901) dan dinamakan hukum Raoult.
Hukum Raoult hanya berlaku pada campuran yang identik dalam struktur kimianya,
seperti benzena dan toluena. Kebanyakan peristiwa lain menyimpang dari hukum
ini. Juga, jika sebuah komponen hanya terlarut sedikit dalam komponen lainnya,
kecenderungannya untuk menguap meningkat.
Salah
satu contoh dari distilasi adalah pemurnian air laut. Air laut dipanaskan
sehingga uap air murni meninggalkan garam, dan didinginkan. Proses ini
dilakukan beberapa kali air yang didapat semakin baik kadar kemurniannya (lihat
gambar kiri). Contoh lainnya adalah pembuatan whiski yang mengambil alkohol
yang didistilasi dari larutan alkohol-air (lihat gambar kanan).
Distilasi
sederhana adalah proses distilasi paling sederhana yang memanfaatkan titik
didih yang berbeda dari tiap komponen campuran. Perbedaan titik didih dari
masing-masing komponen harus memiliki perbedaan yang cukup besar, karena
prosesnya yang sederhana tersebut tidak dapat memastikan dua (atau lebih)
komponen dari campuran tersebut terpisah dengan baik.
Distilasi
bertingkat adalah distilasi yang memanfaatkan kolom berfraksi agar distilat
yang dihasilkan memiliki tingkat kemurnian yang tinggi, atau untuk memisahkan
senyawa-senyawa yang memiliki titik didih berdekatan. Prinsipnya adalah
menggunakan pori-pori dari material sehingga uap mengalami kondensasi terus
menerus. Hal ini menyebabkan senyawa yang memiliki titik didih lebih rendah
untuk terus menuju ke atas dan senyawa yang memiliki titik didih lebih tinggi
mengalami kondensasi dan turun lagi. Hal ini membuat senyawa yang diteruskan ke
kolom kondensasi benar-benar merupakan hasil distilat yang diinginkan. Prinsip
distilasi bertingkat sering digunakan dalam industri (contoh: industri
petroleum), hanya saja skala (dan tentu saja alat) yang digunakan berbeda
dengan yang digunakan di laboratorium.
Sistem
azeotrop adalah campuran yang memiliki perbandingan yang tetap dari
komponen-komponennya walaupun didistilasi. Contoh yang paling umum adalah etil
alkohol (etanol) – air dengan perbandingan 95,57% dan 4,43%. Pemisahan tidak
dapat dilakukan dengan distilasi biasa. Salah satu cara untuk memisahkannya
adalah dengan menambahkan bahan kimia lain, misalnya pada contoh di atas adalah
penambahan benzena.
C. Data Fisik dan Kimia
Nama Zat
|
Titik Didih (oC) 1 atm
|
Titik Leleh (oC) 1 atm
|
Indeks Bias (20 oC)
|
Metanol
|
64,7
|
-99
|
1,3289
|
Toluena
|
109
|
-84,5
|
1,4940
|
Air
|
100
|
0
|
1,3330
|
Benzena
|
79
|
6,7
|
1,4991
|
Siklohexana
|
81
|
6
|
1,4260
|
D. Pereaksi dan Alat
Pereaksi
·
Metanol (l)
·
Air (l)
·
Sikloheksana (l)
·
Toluen (l)
·
Benzen (l)
Alat
·
batu didih
·
labu bundar 100 ml
·
Bunsen
·
Termometer
·
Gelas kimia
·
Tabung reaksi besar
·
Klem
E. Diagram Alir
Distilasi Sederhana
Distilasi Bertingkat
Distilasi Azeotrop Terner
F. Cara Kerja dan Pengamatan
Cara
Kerja
|
Pengamatan
|
|||||||||||||||||||||
1.
Distilasi Sederhana
·
Rangkai peralatan distilasi sederhana
·
Masukkan 40 ml campuran methanol-air
( 1:1) ke dalam labu
·
Panaskan dengan api yang diatur
perlahan naik sampai mendidih
·
Atur pemanasan sampai distilat
menetes teratur (kec : 1 tetes/detik)
·
Amati dan catat suhu dimana tetes
pertama jatuh
·
Ganti penampung dengan yang bersih,
kering,berlabel untuk menampung distilat murni (distilat yang suhunya sudah
mendekati suhu didih, T konstan)
·
Catat volume distilat secara teratur
setiap selang jumlah distilat
·
Hitung indeks bias distilat
|
Indeks Bias Metanol = 0,13301
|
|||||||||||||||||||||
2. Distilasi Bertingkat
·
Rangkai peralatan distilasi
bertingkat
·
Masukkan 40 ml campuran
sikloheksana-toluen (1:1) kecdalam labu
·
Masukkan batu didh
·
Lakukan distilasi
·
Hitung indeks bias distilat
|
Indeks Bias Sikloheksana = 1,440
|
|||||||||||||||||||||
3. Distilasi Azeotrop Terner
·
Masukkan 25 ml methanol-air ke dalam
labu bundar 100 ml
·
Tambahkan 12,5 ml Benzena
·
Rangkai perlatan distilasi bertingkat
·
Lakukan distilasi
·
Catat suhu dan volume distilat
·
Hentikan distilasi bila sisa campuran
dalam labu tinggal 3-4 ml
·
Jangan sampai kering
·
Ganti penampung setiap anda kira
sudah mencapai titk didih zat murni
·
Hitung indeks bias distilat
|
Indeks Bias Metanol = 0.13385
Indeks Bias Benzena = 0.14958
|
G. Perhitungan dan Analisis
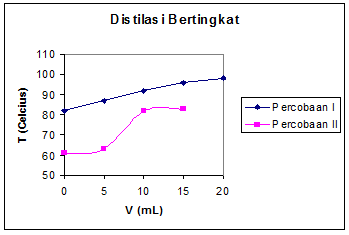
Distilasi Sederhana
Dapat dilihat dari grafik bahwa campuran
metanol-air memiliki kurva naik secara teratur, antara penambahan temperatur
dengan penambahan volume distilat. Secara teoritis, jika distilasi berjalan
dengan sempurna, maka volume distilat yang mengandung metanol dengan
konsentrasi tinggi akan berada sekitar 20 mL, karena metanol dalam campuran
bervolume 20 mL, dan distilat mengandung metanol dan sedikit air. Namun kami
hanya dapat mencapai 13 mL karena kelompok kami memiliki masalah dengan bunsen yang
diberikan. Bunsen memiliki api yang terlalu kecil dan tidak bisa diperbesar
(jika diperbesar akan mati) sehingga membuat percobaan berjalan dengan sangat
perlahan.
Dari data didapat tetesan pertama terjadi pada
suhu 66oC. Dengan titik didih air 100oC dan metanol 64,7oC
seharusnya secara kasar campuran 1:1 metanol-air mulai mendidih pada suhu
sekitar 80 oC. Namun karena pengukuran dilakukan di Bandung, di mana
tekanan udaranya lebih rendah dari pada tekanan permukaan laut, titik didih
masing-masing bahan lebih rendah dari pada literatur. Pada tekanan udara
Bandung, titik didih air berada pada sekitar 80oC. Sehingga bisa
dilihat mengapa tetesan pertama terjadi pada suhu 66oC, yaitu tidak
lain karena tekanan udara Bandung yang lebih rendah dari tekanan udara
permukaan laut (standar literatur).
Penghitungan indeks bias menunjukan kemurnian
distilat. Indeks bias hasil perhitungan menunjukkan bahwa nilai indeks bias
sebesar 0,13301. Indeks bias hasil perhitungan ternyata meleset jauh dari data
literatur, 1,3289. Kesalahan perhitungan ini tidak memungkinkan kami untuk
menilai kemurnian metanol yang didapat. Kemungkinan kesalahan kami terjadi
karena keterburu-buruan untuk melihat hasil dari perhitungan indeks bias karena
waktu yang sempit dan alat yang terbatas. Probabilitas terbesar, kami salah
membaca sehingga hasil yang didapat hanya 1/10 dari seharusnya. Jika kita
mengalikan hasil yang didapat dengan faktor pengali 10, maka dapat dikatakan
kemurnian dari metanol-air sangatlah baik. Hal ini terjadi karena percobaan
dihentikan pada suhu yang relatif masih rendah.
Distilasi Bertingkat
|
|
Distilasi bertingkat dilakukan oleh meja sebelah,
dan menurut hasil diskusi, mereka sebenarnya melakukan percobaan
berulang-ulang. Hal ini dikarenakan masalah bunsen yang justru bertolak
belakang dengan masalah kami, yaitu api yang terlalu besar, dan bila dikecilkan
akan mati.
Hasil perhitungan indeks bias distilat
(sikloheksana) menunjukkan permunian berjalan dengan cukup baik. Indeks bias
hasil perhitungan adalah 1,440. Bandingkan dengan indeks bias literatur sebesar
1,4260. Kemungkinan besar terjadi kesalahan pada pembacaan skala nonius yang
relatif sulit.
Distilasi Azeotrop Terner
Dari grafik terlihat bahwa, dari volume 5mL sampai
10 mL grafik kenaikan suhu berjalan lambat (hanya 1oC) ditinjau dari
kecepatan tetesan distilat yang dianggap konstan. Dari sini dapat ditarik
asumsi bahwa titik didih metanol berkisar pada nilai 50oC. Hal ini
dikarenakan kalor dari bunsen lebih banyak dipakai untuk mengubah fasa metanol
dibandingkan untuk menaikkan suhu campuran.
Setelah 10 mL dari metanol didapat (sekitar 80%
dari komposisi awal metanol), grafik suhu mulai naik dengan tajam, sebelum
kembali melandai pada volume 15 mL - 20 mL.
Distilat yang diperoleh pada selang penambahan
volume dari 15 mL – 20 mL ini seharusnya menurut urutan titik didih (metanol
64,7oC, benzena 80,1oC dan air 100oC),
sebagian besar merupakan benzena karena 12,5 mL metanol awal telah dapat
dipastikan telah berada pada labu penampung hasil distilasi. Melandainya grafik
suhu sesuai dengan perkiraan, yaitu ketika kalor dari bunsen lebih banyak
dipakai untuk menguapkan benzena daripada menaikkan suhu campuran.
Baru setelah 67oC suhu kembali naik
dengan tajam, pertanda bahwa kebanyakan benzena pada labu distilasi telah
berubah fasa menjadi fasa uap.
Pengukuran pada indeks bias kelompok kami kembali
menunjukkan kesalahan seperti pada distilasi sederhana (baca: Analisa Distilasi Sederhana alinea 3), di mana indeks bias
yang didapat (metanol 0,13385 dan benzena 0,14958) mendekati 1/10 dari nilai
literatur. Jika hasil yang didapat dikalikan dengan faktor pengali 10, angka
yang didapat hampir mendekati data literatur (metanol 1,3289 dan benzena
1,4991). Hal ini menunjukkan bahwa komponen yang didapat berada pada kemurnian
yang baik.
H. Kesimpulan dan Saran
Kesimpulan dari percobaan ini adalah sebagai
berikut:
1.
Besarnya
api dari bunsen sangat mempengaruhi laju tetes pada distilat. Maka bunsen yang
dipakai harus berada dalam keadaan baik.
2.
Distilasi
bertingkat lebih akurat dari distilasi sederhana, di mana data indeks bias yang
didapat, baik dari percobaan 2 maupun percobaan 3, lebih mendekati literatur
dibandingkan dengan distilasi sederhana. Hal ini menunjukkan kadar kemurnian
yang lebih baik
3.
Ketelitian
saat membaca skala untuk menghitung indeks bias sangatlah diperlukan.
4.
Untuk
ketiga percobaan ini keberadaan titik didih tidak begitu diperlukan, karena
ternyata bumping yang terjadi berada pada level yang rendah. Namun untuk
menjaga akurasi data, lebih baik jika batu didih tetap diberikan.
5.
Benzena
yang dipakai pada azeotrop tidak lain untuk “menyegel” larutan metanol dan air,
sehingga tidak saling larut kembali. Hal ini menunjukkan bahwa pemilihan zat
kimia ketiga pada sistem azeotrop (seperti benzena pada percobaan azeotrop
terner di atas) harus memiliki titik didih di antara kedua komponen lainnya dan
tidak larut, baik pada komponen yang satu maupun komponen lainnya.
6.
Kesimpulan
akhir, karena banyaknya alat yang pecah, tuntutan untuk berhati-hati dalam
melakukan praktikum sangatlah besar, karena sebagian besar alat bersifat fragile.
Saran yang dapat diberikan:
Tidak banyak hal yang bisa dikritik, selain lab
kimia organik yang kekurangan asisten. Dengan kurang terpantaunya praktikan,
kemungkinan praktikan untuk melakukan kesalahan semakin besar, dengan demikian
hasil yang didapat juga semakin jauh dari yang diharapkan. Untuk praktikum
berikutnya diharapkan jumlah asisten sudah memadai, sehingga praktikum dapat
dilakukan dengan baik.
I. Daftar Pustaka
Microsoft Encarta Reference Library 2004 Distillation, Sub Judul Introduction,
Theory of Distillation, Fractional Distillation.
Perry ‘s Chemical Engineers’ Handbook, Physical and Chemical Data.
Wilcox, Charles F. Jr and Mary F. Wilcox. 1995. Experimental Organic Chemistry. USA: Prentice
Hall Inc. hal 43-45
www.wikipedia.com
Azeotrope






0 komentar:
Posting Komentar