Percobaan 8
Aldehid dan Keton: Sifat Fisik dan Reaksi Kimia
I. Tujuan Percobaan
Praktikan mengidentifikasi
senyawa-senyawa aldehid dan keton berdasarkan sifat-sifat fisik dan kimianya
dengan menggunakan berbagai pereaksi.
II. Teori Dasar
Dalam kimia
organik, gugus fungsi merupakan bagian dari struktur molekul yang dicirikan
oleh komposisi dan ikatan tertentu dari penyusunnya, yang menentukan reaktifitas
molekul secara keseluruhan.
Aldehid dan keton merupakan
senyawa organik yang sama-sama memiliki gugus fungsi karbonil, yakni gugus
fungsi yang terdiri dari sebuah atom karbon yang berikatan rangkap dua dengan
sebuah atom oksigen. Bedanya, gugus karbonil pada aldehid terletak pada posisi
terminal, dan pada keton internal.
Karena atom
oksigen memiliki keelektronegatifan yang besar, maka gugus karbonil bersifat
polar. Selain itu, keberadaan pasangan elektron bebas pada oksigen membuatnya
dapat beresonansi, sekaligus membuat aldehid dan keton memiliki kemampuan untuk
melakukan ikatan hidrogen.
Kebanyakan
aldehid dan keton mengalami reaksi pada atom karbon a (alfa), yaitu atom karbon
yang bersebelahan dengan gugus karbonil. Reaksi yang terjadi pada atom karbon a ini
dapat berupa reaksi subtitusi, adisi, maupun eliminasi, yang dapat berlangsung
dengan mekanisme elektrofilik maupun nukleofilik. Sedangkan reaksi oksidasi
dan/atau reduksi biasanya terjadi pada atom karbon dari gugus karbonil itu
sendiri.
Walaupun
sama-sama memiliki gugus karbonil, ternyata aldehid dan keton dapat mengalami
reaksi yang berbeda. Reaksi-reaksi spesifik ini dapat digunakan untuk
membedakan senyawa-senyawa aldehid dengan keton, atau untuk mengidentifikasi
apakah suatu senyawa tak dikenal termasuk golongan aldehid atau keton.
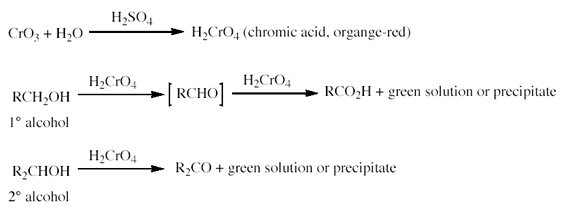
Aldehid dapat
terbentuk akibat dehidrogenasi alkohol primer. Dengan simbol [O] sebagai zat
pengoksidasi, maka reaksi yang terjadi pada dehidrogenasi alkohol primer
adalah:
Keton dapat
tebentuk akibat dehidrogenasi alkohol sekunder. Jika ditulis seperti di atas,
maka reaksi yang terjadi saat dehidrogenasi alkohol sekunder adalah:
Akan tetapi,
jika yang dihidrogenasi adalah alkohol tersier, maka tidak akan terjadi reaksi
apapun karena tidak ada hidrogen yang dapat dilepaskan untuk bereaksi dengan
hidrogen dari OH-
membentuk H2.
Ada beberapa cara yang dapat dilakukan untuk
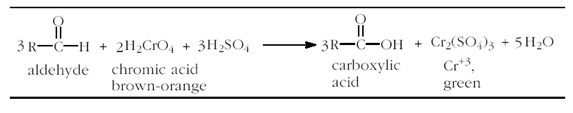
membedakan aldehid dengan keton. Cara yang pertama adalah dengan uji asam
kromat. Uji ini berdasarkan pada proses oksidasi aldehid oleh asam kromat.
Perbedaan antara aldehid dengan keton dapat dilihat dengan proses ini karena
asam kromat mengoksidasi aldehid tapi tidak mengoksidasi keton. Dengan uji ini,
pengamatan yang dapat dilakukan adalah perubahan warna Cr (VI) yang berwarna
merah-jingga menjadi Cr (III) yang berwarna biru-hijau.
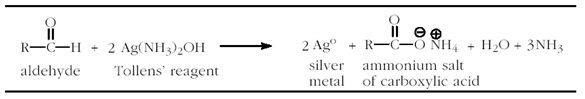
Uji lain yang
dapat dilakukan untuk membedakan adalah dengan uji Tollens. Dengan menggunakan
pereaksi Tollens, aldehid akan teroksidasi sedangkan keton tidak. Pereaksi Tollens
yang merupakan campuran Ag(NH3)+ dan larutan basa akan
membentuk endapan perak saat direduksi.
Selain itu,
dapat juga dilakukan uji iodoform untuk membedakan keton dengan aldehid. Pada
uji ini, jika iod direksikan dengan keton atau asetaldehid, maka akan timbul
endapan kuning. Hal ini tidak terjadi pada aldehid lain.
Uji 2,4
dinitrohydrazin dilakukan untuk menentukan adanya ikatan rangkap antara O
dengan C. Senyawa akan membentuk warna merah, jingga, atau kuning dan membentuk
endapan jika terdapat ikatan rangkap antara O dengan C dan merupakan senyawa
aldehid atau keton.
III. Data
Uji Asam Kromat
Larutan |
Warna awal
(+
Asam Kromat)
|
Setelah 10 menit |
Keterangan |
Benzaldehid
Sikloheksanon
Aseton
Sampel
|
Kuning
Merah-kecoklatan
Merah-kecoklatan
Merah-kecoklatan
|
Ada
endapan
Tetap
Tetap
Tetap
|
Terbentuk
2 fasa, lapisan atas berwarna kehijauan
|
Uji Tollens
Larutan |
+ Tollens
|
|
Warna larutan |
Lapisan perak |
|
Benzaldehid
Sikloheksanon
Aseton
Sampel
|
Hitam
Hitam
Bening
gelap (tak bereaksi)
Hitam
|
Ada
Tak ada
Tak ada
Ada
|
Uji Iodoform
Larutan |
+ Air
|
+Dioksan
|
+ 2ml
NaOH
|
+ KI
|
Benzaldehid
Sikloheksanon
Aseton
Sampel
|
Ada minyak
di bawah tabung reaksi
Keruh
Homogen
Keruh
|
Homogen
dan tak homogen
Homogen
Homogen
Homogen
|
Keruh
Keruh
Homogen
Keruh
|
Homogen
(dilarutkan dengan dioksan sampai satu fasa) : tidak ada hasil
Tidak
homogen (keruh) : ada endapan
Dua
fasa, putih - kuning
Putih,
ada endapan kuning
Putih
keruh,ada fasa minyak
|
Uji 2,4-Dinitrofenilhiyrazin
Larutan |
+
2,4-Dinitrofenilhiydrazin
|
Keterangan |
Benzaldehid
Sikloheksanon
Aseton
Sampel
|
Oranye
keruh
Kuning
kecoklatan
Kuning
kecoklatan
Kuning
kecoklatan
|
Terbentuk
endapan oranye
Terbentuk
kristal
Terbentuk
kristal
Terbentuk
kristal
|
IV. Pembahasan
Ideal
A.
Uji Asam Kromat
.
Pada percobaan
ini, aldehid akan dioksidasi oleh asam kromat, sedangkan keton tidak. Ketika
aldehid dioksidasi oleh asam kromat yang berwarna merah-jingga menjadi asam
karboksilat, asam kromat akan tereduksi menjadi Cr+3 yang berwarna
hijau. Dari seluruh zat yang diuji, zat yang akan bereaksi adalah benzaldehid.
Reaksi oksidasi
aldehid yang terjadi adalah sebagai berikut:
Sebenarnya, uji
asam kromat tidak hanya spesifik untuk membedakan aldehid dan keton, melainkan
juga dapat digunakan untuk mengidentifikasi alkohol primer dan juga alkohol
sekunder. Hal ini disebabkan oleh sifat alkohol primer, alkohol sekunder, dan
aldehid yang masih dapat dioksidasi menjadi senyawa lainnya, sedangkan alkohol
tersier, asam karboksilat dan keton tidak dapat dioksidasi lebih lanjut oleh
asam kromat. Reaksi alkohol primer, dan alkohol sekunder dengan asam kromat
adalah sebagai berikut.
B. Uji Lodoform
Metil keton dapat dibedakan dari keton yang lain
dengan uji iodoform. Metil keton direaksikan dengan iodin di dalam air atau
larutan NaOH. Warna kuning yang terbentuk merupakan warna dari iodoform yang
berupa padatan CHI3 yang terbentuk ketika suatu metil keton bereaksi
dengan iodin. Deprotonasi metil keton hidrogen menghasilkan anion
yang akan menyerang iodin. Ketika atom iod
pertama sudah melekat
metil hidrogen yang tersisa akan menjadi lebih asam,
sehingga deprotonasi akan terjadi dan akan memacu terjadinya penyerangan
terhadap iod hingga semua atom hidrogen dalam metil keton yang tersisa akan
digantikan oleh atom iod hingga terbentuknya spesi tri-iodo RCOCI3
Suasana basa menyebabkan penambahan gugus
hidroksil pada karbonil sehingga terbentuknya
Reaksi ini
bersifat reversibel, tapi anion(dalam lingkaran) dapat menyebabkan eliminasi
anion CI3- . Setelah eliminasi, anion CI3-
mengambil satu proton untuk membentuk iodoform(CHI3) yang
berupa padatan kristal berwarna kuning. Pembentukan padatan kristal berwarna
kuning ini menunjukkan hasil pengujian yang positif, pembentukan selain kristal
kuning ini menunjukkan hasil negatif.
C. Uji 2,4 dinitrofenilhydrazin
Uji 2,4 dinitrofenilhydrazin menunjukkan hasil positif
untuk aldehid dan keton, tapi tidak
untuk alkena, ester, amida ataupun asam. Uji ini menunjukkan bagaimana H2N-Z
reagen bereaksi dengan aldehid ataupun keton untuk mengeliminasi air dan
membentuk ikatan C=N-Z. DNP dapat larut dalam air, tetapi setelah bereaksi
dengan aldehid atau keton maka senyawa yang terbentuk langsung mengendap dari
larutan. Warna dari endapan yang terbentuk dapat memberi informasi tertentu.
Senyawa karbonil jenuh cenderung memberikan warna kuning, sedangkan aldehid
atau keton yang tidak jenuh memberikan warna merah atau oranye. Eksperimen ini
sangat baik sebagai penguji ketika keberadaan aldehid dan keton tidak
diketahui. Uji ini juga sangat bagus untuk membuat derivat padat yang dapat
dimurnikan dengan teknik rekristalisasi dan diukur titik didihnya sehingga
diketahui senyawa aldehid ataupun keton apakah sampel tersebut.
D. Uji Tollens
Uji Tollens
merupakan alternatif klasik dari uji Schiff. Reagen Tollens adalah larutan AgOH
(sebenarnya Ag(NH3)2OH) yang dapat larut. Ketika
dicampurkan dengan aldehid, aldehid dioksidasi menjadi asam karboksilat, kation
Ag+ direduksi menjadi elemen Ag(s) . Perak yang terbentuk
menutupi dasar tabung reaksi dan cermin perak dapat diamati.
Aktual
A. Uji Asam Kromat
Pada uji asam
kromat, hanya benzaldehid yang menunjukkan adanya perubahan warna menjadi
hijau. Endapan yang terbentuk pada dasar tabung reaksi adalah Cr2(SO4)3.
Hal ini sesuai dengan teori, karena keton tidak dapat dioksidasi lagi,
sedangkan aldehid dapat dioksidasi menjadi asam karboksilat.
Larutan sampel
tidak mengalami perubahan, berarti sampel kemungkinan tidak memiliki gugus
aldehid.
B. Uji Tollens
Ketika reagen Tollens (suatu larutan basa (dari) ion
kompleks perak-amonia) dimasukkan ke dalam larutan benzaldehid, warna larutan
menjadi hitam lalu terbentuk lapisan perak pada dinding tabung reaksi. Hal ini
menunjukkan bahwa terjadi reaksi oksidasi aldehid oleh reagen Tollens menjadi
anion karboksilat dan reaksi reduksi ion perak menjadi logam perak. Reaksinya
adalah sebagai berikut :
Pada larutan
sikloheksanon dan propanon/aseton warna larutan berubah menjadi lebih gelap
ketika ditambahkan reagen Tollens, tetapi tidak terbentuk lapisan perak pada
dinding tabung reaksi. Hal ini menunjukkan bahwa tidak terjadi reaksi reduksi
ion perak menjadi logam perak.
Aldehid mudah
mengalami oksidasi sedangkan keton sulit dioksidasi. Oksidasi keton ini harus
memakai oksidator yang sangat kuat dan memutuskan salah satu cabang alkil[1].
Hal inilah yang menyebabkan reaksi reduksi ion perak menjadi logam perak hanya
terjadi pada larutan benzaldehid.
Pada penambahan
reagen Tollens ke dalam larutan tak dikenal terjadi reaksi yang serupa dengan
reaksi pada benzaldehid, yaitu terbentuknya lapisan perak pada dinding tabung
reaksi. Hal ini menunjukkan sampel mungkin termasuk dalam golongan senyawa
aldehid
C. Uji Iodoform
Dapat dilihat,
hasil dari penambahan KI beraneka ragam. Benzaldehid (tak homogen) yang
seharusnya tidak dapat dioksidasi oleh iod ternyata menghasilkan endapan. Hal
ini dikarenakan penambahan dioksan dilakukan tidak sampai larutan homogen. Pada
penambahan dioksan sampai homogen pada larutan benzaldehid tidak terdapat
endapan, yang sesuai dengan teori.
Pada sikloheksanon
dan sampel terbentuk dua fasa, yang tidak menandakan hasil positif dari uji
iodoform.
Pada aseton
didapat endapan kuning, yang merupakan hasil positif dari uji iodoform. Hasil
ini sesuai dengan literatur, di mana iod hanya dapat mengoksidasi aseton,
asetaldehid, etanol dan alkohol sekunder.
D. Uji 2,4 dinitrophenylhydrazine
Pada uji 2,4
dinitrophenylhydrazine benzaldehide menunjukkan hasil yang berbeda dengan
heksanon, aseton dan sampel. Hasil reaksi 2,4 dinitrophenylhydrazine dengan
benzaldehide menghasilkan endapan oranye, sedangkan sisanya menghasilkan
endapan kristal. Dari hasil ini dapat disimpulkan kalau heksanon, aseton dan
sampel memiliki kesamaan. Dari uji dinitrophenylhydrazine disimpulkan sampel
kemungkinan termasuk dalam keton.
V. Kesimpulan
1.
Dari uji asam kromat, sampel tidak termasuk dalam
golongan aldehid.
2.
Dari uji iodoform, sampel tidak termasuk metil keton
maupun asetaldehid.
3.
Dari uji 2,4 dinitrophenylhydrazine sampel yang diuji
termasuk dalam golongan keton.
4.
Dari uji Tollens sampel termasuk dalam golongan
aldehid. Hal ini bertentangan dengan uji asam kromat dan uji 2,4 dinitrophenylhydrazine.
Hal ini dapat terjadi karena terjadi kesalahan praktikan, seperti pencucian
tabung reaksi yang tidak baik.
5.
Uji asam kromat dapat dipakai untuk identifikasi gugus
aldehid.
6.
Uji iodoform dapat dipakai untuk identifikasi metil
keton dan asetaldehid.
7.
Uji 2,4 dinitrophenylhydrazine dapat dipakai untuk
identifikasi gugus keton dan aldehid.
8.
Uji Tollens dapat dipakai untuk identifikasi gugus
aldehid.
VII. Daftar Pustaka
Fessenden & Fesenden.2003.Kimia Organik Jilid 1. Jakarta:
Erlangga
Perry, Robert.H and W. Green. 1999. Perry’s Chemical Engineers’ handbook. Mc Graw-Hill: New York
Wertheim, E., Harold Joskey, 1956, Introductory Organic Chemistry 3rd ed. hal 106-121. Mc Graw Hill Book Company Inc
http://chemed.chem.purdue.edu/genchem/topicreview/bp/2organic/aldehyde.html
http://acpcommunity.acp.edu/Facultystaff/genchem/GC2/lab/qual/iodo.htm
http://acpcommunity.acp.edu/Facultystaff/genchem/GC2/lab/qual/dnp.htm










0 komentar:
Posting Komentar